 ▲示意图 | 来源网络
▲示意图 | 来源网络
截至2024年底,中国登记细胞治疗类临床试验489项,占全球总量47%,仅次于美国,标志着我国在这一赛道的快速崛起与全面布局。
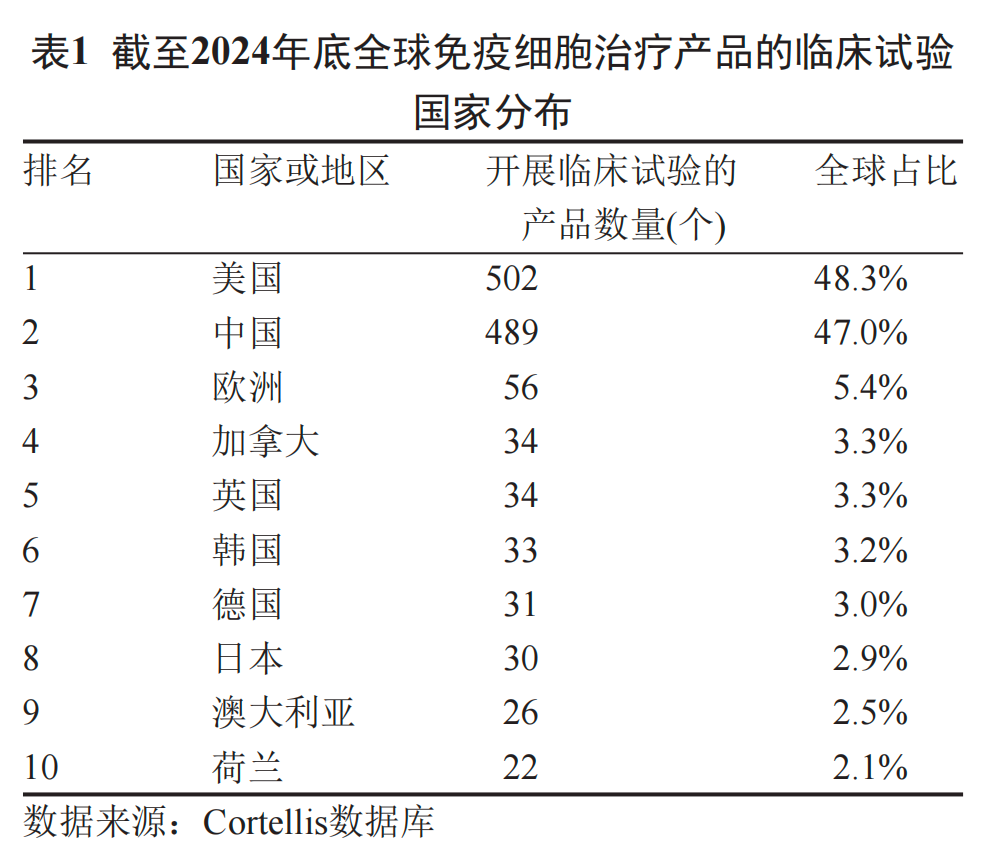 ▲示意图 | 数据来源网络
▲示意图 | 数据来源网络
一 全球产业爆发:技术突破与生态构建
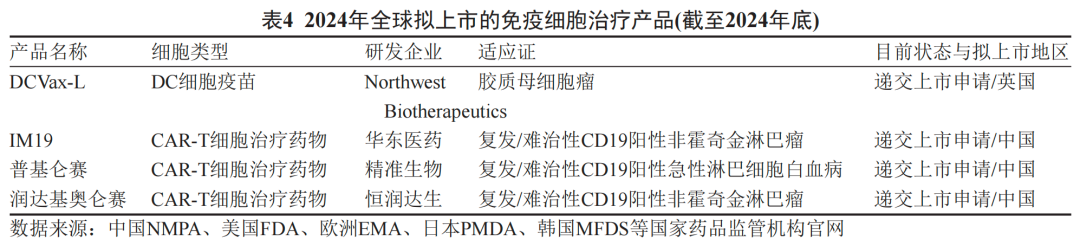
全球细胞治疗产业已进入黄金发展期,以嵌合抗原受体T细胞(CAR-T)为代表的免疫治疗技术在血液系统恶性肿瘤领域实现历史性突破;
2023年,肿瘤浸润淋巴细胞(TIL)疗法获批用于黑色素瘤治疗,标志着实体瘤治疗的关键进展,打破了CAR-T疗法在血液瘤领域的局限。
 ▲示意图 | 数据来源网络
▲示意图 | 数据来源网络
技术进步与资本热潮形成共振:2023年全球细胞与基因治疗领域融资规模创历史新高,跨国药企如诺华、吉利德通过并购整合加速布局,中小型创新企业则聚焦TCR-T、CAR-NK、iPSC来源细胞等新兴技术。政策层面,美国、欧盟及日本相继建立快速审批通道(如FDA的再生医学先进疗法认定),优化监管框架以缩短创新疗法的转化周期,形成技术、资本、政策协同驱动的产业生态。
二 中国崛起:从临床规模到技术创新的全面进阶
中国在全球免疫细胞治疗竞赛中展现出强劲动能,截至2024年底的临床试验数量占全球近半,稳居第二大研究阵地。从技术分布看,CAR-T疗法以66.7%的占比保持主导,CIK、TCR-T、CAR-NK及TIL等技术的临床探索同步加速,形成多元化技术布局;适应症从血液肿瘤向肺癌、肝癌、胃癌等高发实体瘤扩展,同时覆盖感染性疾病、自身免疫病等更广泛领域,体现出临床应用的广谱化趋势。
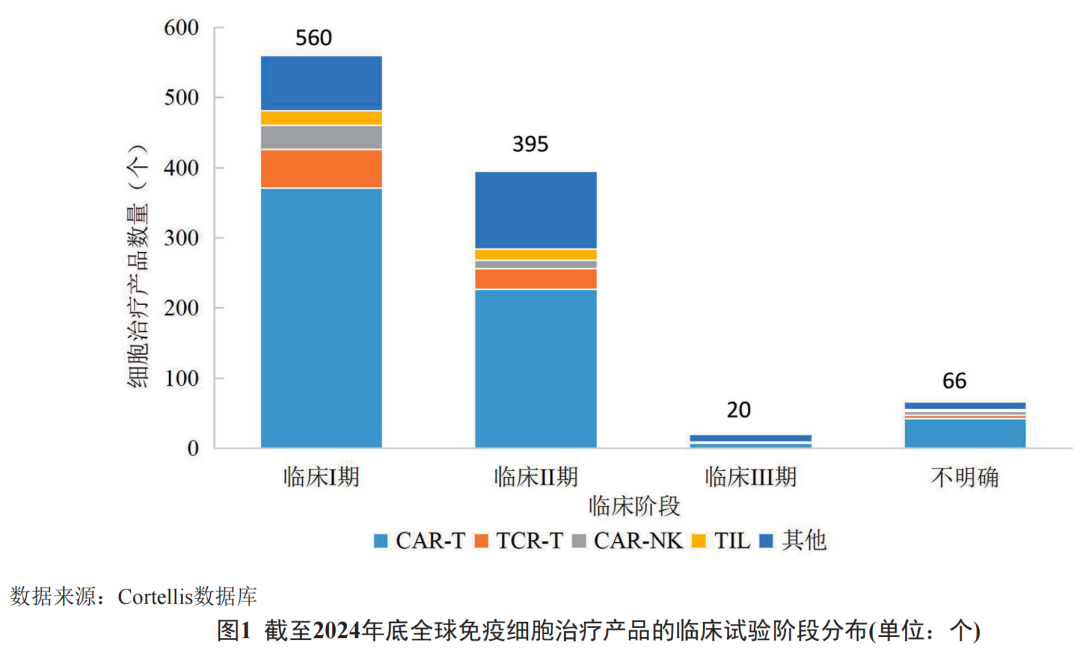 ▲示意图 | 数据图表来源网络
▲示意图 | 数据图表来源网络
本土科研与产业界在关键技术方向实现突破:中科院系统、高校及创新企业在多靶点CAR构建、非病毒载体转导(如转座子系统)、TIL高效扩增、iPSC来源细胞分化等领域取得原创成果,部分研究发表于《自然·医学》《细胞·干细胞》等顶级期刊。例如,针对实体瘤微环境的CAR-T细胞设计优化,通过引入细胞因子分泌模块或抗纤维化因子,显著提升了治疗靶点的特异性与肿瘤浸润能力,为解决实体瘤治疗耐药问题提供了新路径。
三 政策赋能与产业集聚:三力合流加速转化
中国免疫细胞治疗的崛起得益于政策支持、产业集聚与技术创新的深度协同。监管层面,国家药监局发布《细胞治疗产品注册审评技术指导原则(试行)》,建立规范化的质量控制与临床评价标准;海南博鳌乐城、广东深圳、上海浦东等地设立特许准入试点,允许临床急需的境外细胞治疗产品先行使用,形成“政策试验田”加速技术转化。
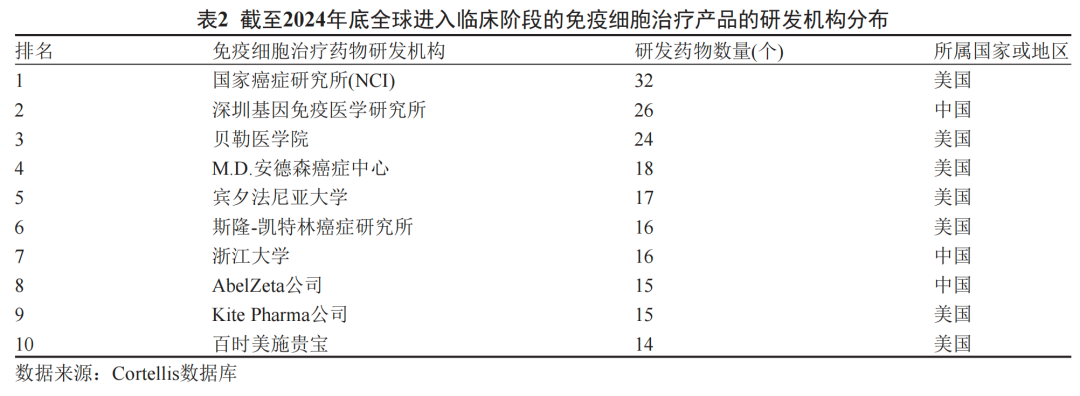 ▲示意图|来源网络
▲示意图|来源网络
四 战略机遇与挑战并存
报告指出,未来五年全球细胞治疗产业将保持20%-25%的年复合增长率,应用场景从肿瘤治疗延伸至神经退行性疾病、器官纤维化、代谢性疾病等领域。中国凭借庞大的患者基数、完善的临床试验体系及成熟的产业链配套,已具备冲刺全球领先地位的基础。然而,原创基础研究占比不足(目前约30%的临床试验为跟随式创新)、高端制造能力薄弱(如病毒载体产能、无血清培养基国产化率低)及国际化注册经验欠缺,仍是亟待突破的挑战。
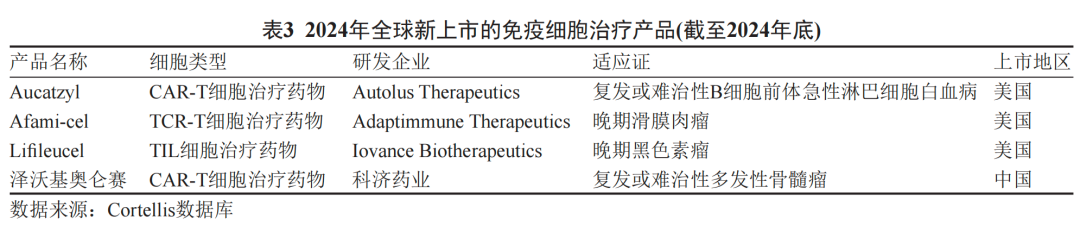
 ▲示意图 | 数据来源网络
▲示意图 | 数据来源网络
结语 /conclusion
免疫细胞治疗的兴起不仅是医学技术的迭代,更是国家科技竞争力的角力。中国以近500项临床试验的规模,印证了从跟跑到并跑的蜕变,而政策、资本、技术的协同共振,正为这一领域的突破注入持续动能。在精准医疗的时代浪潮中,免疫细胞治疗不仅是疾病治疗的新选择,更是重构未来医疗体系的核心抓手。随着技术成熟与产业落地,中国有望在这场生命科技革命中书写“创新驱动”的新篇章,为全球患者带来更多治疗可能。